Cours de chimie 1ère année discipline fondamentale et option spécifique
Étiquetage des produits toxiques
Substances et mélanges doivent être emballés et étiquetés en fonction de leur dangerosité.
• Des pictogrammes permettent de visualiser les principaux dangers et le potentiel de danger de la substance.
• Des mentions de danger décrivent la nature et le degré des dangers.
• Des conseils de prudence indiquent les précautions d'utilisation à observer.
La fiche de données de sécurité fournit des informations plus précises sur la substance. Elle comporte notamment des indications sur le produit, sur les dangers et par là même sur les mesures de protection qu'il implique ainsi que sur la protection de l'environnement. Pour harmoniser à l’échelle internationale le classement et l’étiquetage des produits chimiques, l’ONU a élaboré le système d’étiquetage SGH. L’introduction du SGH en Suisse est progressive. Pendant une phase transitoire de plusieurs années (→ 2017), les deux systèmes (directives européennes et SGH) seront utilisés en parallèle. Attention, l'absence d'un étiquetage de sécurité ne signifie nullement que la substance n'est pas dangereuse !
| Image | Le cours | Les compléments |
 | Chimie générale.I.mesures de sécurité.th.1à12 Etiquette (résumé) Chimie générale.I.mesures de sécurité.ex. Chimie générale.I.mesures de sécurité.sol. | Directives suisses (ne sont plus valables) Directives européennes (valables jusqu'au 1.12.2010) SuvaPro (document) (animation) Directives SGH (valables à partir du 1.12.2010) Centre d'information toxicologique Infochim (site) (film) Explications des pictogrammes SGH (animation) |
La matière
La matière est la substance qui compose tout corps ayant une réalité tangible. Ses trois états les plus communs sont l'état solide, l'état liquide, l'état gazeux. La matière occupe de l'espace et possède une masse. Ainsi, en physique, tout ce qui a une masse est de la matière.
| Image | Le cours | Les compléments |
 | Théorie p.13 à 19 (prof.) Théorie p.20 à 24 (prof.) Exercices Solutions | Techniques de séparation (document) La matière, c'est quoi ? (film) Solidification (animation) C'est pas sorcier : "Les parfums" (film) Phénomène physique/chimique (film-anglais) Diagramme d'état (animation) Les molécules d'eau en mouvement (animation) C'est pas sorcier : "Au cœur de la matière" (film) C'est pas sorcier : "la glace" (film) |
L'atome
Un atome (grec ancien ατομος [atomos], « que l'on ne peut diviser ») est la plus petite partie d'un corps simple pouvant se combiner chimiquement avec une autre. La théorie atomiste, qui soutient l'idée d'une matière composée de « grains » indivisibles (contre l'idée d'une matière indéfiniment sécable), est connue depuis l'Antiquité, et fut en particulier défendue par Démocrite, philosophe de la Grèce antique. Elle fut disputée jusqu'à la fin du xixe siècle, mais n'est plus au xxie siècle l'objet de la moindre controverse. C'est en particulier sur cette notion d'atome que reposent les sciences de la matière modernes. L'atome n'est cependant plus considéré comme un grain de matière insécable, depuis les expériences de physique nucléaire ayant mis à jour sa structure au début du xxe siècle.
Sir Ernest Rutherford, physicien Néo-Zélandais (1871-1937) démontra en 1911 que les atomes contiennent un noyau; il établit d'autre part que les dimensions du noyau sont infinitésimales, à peu près 100'000 fois plus petites que les dimensions d'un atome, et qu'entre le noyau et les électrons réside un grand espace vide. Cette découverte est à l'origine du modèle planétaire de l'atome. Peu de temps après, il démontra que le noyau contenait des particules chargées positivement, les protons (animation).
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercice d'application Exercices Solutions Ex.supplémentaires (1.1 à 1.5) | Tableau périodique (1), (3), (4), (5), (7), (8) Les gaz "nobles" (video) Tableau périodique "dynamique" L'histoire des recherches sur la matière (film) Comment s'est créée la matière ? (film) Lumière et atomes (animation)Structure électronique (site) C'est pas sorcier : "Le cuivre" (film) C'est pas sorcier : "L'acier" (film) C'est pas sorcier : "L'aluminium" (film) Peut-on transformer le plomb en or ? (film) Les puissance de 10 (théorie, solutions) Pourquoi le verre est-il transparent ? (film) Le voyage atomique (film) |
Les liaisons
La liaison chimique est le phénomène physique qui lie les atomes entre eux en échangeant ou partageant un ou plusieurs électrons ou par des forces électrostatiques.
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Solutions | Laboratoire sur l'eau (document) La covalence pure (PC) (Mac) (animation) La covalence polaire (PC) (Mac) (animation), (HCl) La liaison ionique (PC) (Mac) (animation), l'animation avec NaCl Miscibilité eau-hexane (animation) Pourquoi le savon nettoie-t-il ? (film) Activité (modèles moléculaires) Comment fonctionne un micro-onde ? (film) : |
Les réactions
Une réaction chimique est une transformation de la matière au cours de laquelle les espèces chimiques (atomiques, ioniques ou moléculaires) qui constituent la matière sont modifiées : les espèces qui sont consommées sont appelées réactifs. Les espèces formées au cours de la réaction sont appelées produits (de réaction). Depuis les travaux de Lavoisier (1777), les scientifiques savent que la réaction chimique se fait sans variation mesurable de la masse : « Rien ne se perd, rien ne se crée, tout se transforme » qui traduit la conservation de la masse.
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Solutions | Exemple : la combustion du méthane CH4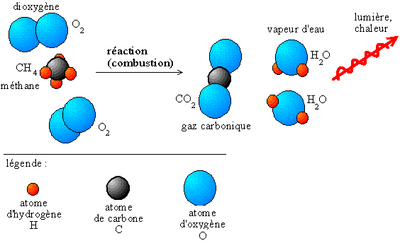 Exercices supplémentaires (équilibrer une équation) Comment équilibrer une équation (film-anglais) Les éléments de la première colonne n'aiment pas l'eau ! (film) : |
La dissolution
La dissociation (solvatation) est le phénomène physico-chimique observé lors de la dissolution d'un composé chimique dans un solvant. Lors de l'introduction d'une espèce chimique initialement à l'état solide dans un solvant, les atomes, ions ou molécules du solide sont liés entre eux. Le produit ne va se se dissocier que si les molécules du solvant réussissent à rompre les liaisons dans le solide :
▪ soit par réaction chimique ;
▪ soit en affaiblissant suffisamment les liaisons (par exemple, l'eau divise les forces électrostatiques par environ 80).
Pour qu'il y ait dissociation, les molécules du solvant doivent donc avoir une affinité avec les constituants du solide. Donc, les espèces dissociées sont entourées par des molécules de solvant. Cette action des molécules de solvant sur le solide constitue la solvatation. La solvatation d'une espèce dépend de la nature du solvant et du soluté. En règle générale, un composé polaire sera très bien solvaté dans un solvant polaire, tandis qu'un composé apolaire sera mieux solvaté dans un solvant apolaire.
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Ex. supplémentaires (3.1 à 3.2) Solutions | Dissolution (animation) Dissolution du sel de cuisine NaCl (PC) (Mac) (animation) Dissolution du sucre (PC) (Mac) (animation) Liste des ions polyatomiques (document) |
La nomenclature
La nomenclature IUPAC est un système pour nommer les composés chimiques et pour décrire la science de la chimie en général. Elle est développée et mise à jour sous les auspices de Union Internationale de Chimie pure et Appliquée (UICPA) ou International Union of Pure and Applied Chemistry : IUPAC.
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Ex. supplémentaires (4.1 à 4.5) Solutions Résumé de nomenclature | Page de nomenclature (document) Liste des ions polyatomiques (document) Etymologie des éléments (document) Exercices de nomenclature ("Ecole en ligne" - Moodle) Quizlet (exercices de nomenclature sur les ions, appli. mobile) Quizlet (liste des préfixes grecs) |
Les réactions de précipitation
Un précipité est la formation d'une phase dispersée hétérogène dans une phase majoritaire. Cela désigne en général la formation d'un cristal solide d'un sel dans un liquide.
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Ex. supplémentaires (7.1 à 7.3) Solutions | Animations (1), (2), (3) Table des solubilités (site) |
Les réactions de neutralisation
En chimie, la neutralisation est une réaction chimique par laquelle un acide et une base réagissent pour former de l'eau et un sel. Dans une solution aqueuse, les ions hydrogène solvatés (ions hydronium, H3O+) réagissent avec les ions hydroxyde (OH -) pour former deux molécules d'eau. Un sel est également formé. Dans un milieu non aqueux, l'eau n'est pas toujours formée, mais il y a toujours un don de protons (voir la théorie de Brønsted-Lowry). Souvent, les réactions de neutralisation sont exothermiques. Un exemple de neutralisation endothermique serait la réaction entre le bicarbonate de sodium et un acide faible, par exemple l'acide acétique (vinaigre).
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Ex. supplémentaires (6.1 à 6.2) Solutions | Animations (1), (2), (3) Neutralisation de HCl par NaOH (image) L'indicateur de pH (indicateur coloré) |
Quantitative - Gravimétrie
La gravimétrie est une méthode d'analyse qui utilise la masse. Elle peut permettre de trouver soit la nature d'un composé (par la quantité de l'un de ses ions), soit la quantité d'une substance dans un mélange. Le principe est de faire réagir chimiquement l'ion, l'élément ou le composé dont on veut connaître la teneur dans l'échantillon. Selon le cas, ce peut être la masse du produit ou la différence de masse de l'échantillon qui permettront de déterminer la teneur ou la nature du produit.
| Image | Le cours | Les compléments |
 | Théorie (prof.) Exercices Solutions Solution 1.4 | La mole (lecture) Réactif limitant (animation) Calculatrice de masse molaire (site) Gaz parfait (vidéo-anglais) La mole (film) |
Bibliographie
| Chimie de base et avancée | Exercices de chimie "Brochure officielle" |
 |  |