Cours de chimie 3ème année option spécifique
Chimie descriptive (OC)
Le tableau périodique des éléments, également appelé table de Mendeleïev, classification périodique des éléments (CPE) ou simplement tableau périodique, représente tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leur configuration électronique, laquelle sous-tend leurs propriétés chimiques. Son invention est généralement attribuée au chimiste russe Dimitri Mendeleïev, qui construisit en 1869 une table différente de celle qu'on utilise aujourd'hui, mais similaire dans son principe, dont le grand intérêt était de proposer une classification systématique des éléments chimiques connus à l'époque en vue de souligner la périodicité de leurs propriétés chimiques, d'identifier les éléments qui restaient à découvrir, et même de pouvoir prédire les propriétés de ces éléments alors inconnus. Le tableau périodique a connu de nombreux réajustements depuis lors jusqu'à prendre la forme que nous lui connaissons aujourd'hui, et est devenu un référentiel universel auquel peuvent être rapportés tous les types de comportements physique et chimique des éléments. En février 2010, sa forme standard comportait 118 éléments, allant de 1H à 118Og.
| Image | Le cours | Les compléments |
 | Théorie Exercices Solutions | Géométrie des molécules par la méthode VSEPR Un des aspects importants de la stéréochimie consiste à expliquer et si possible à prévoir la stéréochimie d'une molécule donnée. En 1957 le chimiste canadien R.J Gillespie (université Mc Master Hamilton, Ontario) reprenant une idée émise par les britanniques N. Sigdwick et H. Powell, a développé les règles de la théorie de répulsion des électrons de la couche de valence (VSEPR de Valence Shell Electron Pair Repulsion). La méthode VSEPR peut être considérée comme le prolongement dans le domaine stéréochimique de la description de la liaison chimique par appariement électronique de G.N Lewis (1916). (A) document (B) dessins 2D (C) animation, (swf) (D) dessins 3D |
L'équilibre
Le principe de Le Chatelier, ou loi générale de modération, déduite d'observations expérimentales, a été énoncé par Henry Le Chatelier en 1884. Ce principe est applicable dans le cadre d'un déplacement d'équilibre, et non pas d'une rupture d'équilibre. Énoncé :« Lorsque les modifications extérieures apportées à un système physico-chimique en équilibre provoquent une évolution vers un nouvel état d'équilibre, l'évolution s'oppose aux perturbations qui l'ont engendrée et en modère l'effet. »
| Image | Le cours | Les compléments |
 | Théorie Exercices Ex. supplémentaires (13.1 à 13.17) Solutions Solutions détaillées (13.1 à 13.17) | Le Chatelier (animation, swf) Le Chatelier (film-anglais) Équilibre entre NO2 et N2O4 (animation, html, swf) Cinétique (film-anglais) |
L'électrochimie
Le saviez-vous ? En 1799, le savant italien Alessandro Volta met au point un empilement successif de disques de cuivre, de zinc et de rondelles de carton imbibées d'eau salée qui produit de l'électricité. C'est cet "empilement" qui a donné son nom à la pile.
| Image | Le cours | Les compléments |
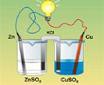 | Théorie Exercices Ex. supplémentaires (19.1 à 19.10) Solutions Solutions détaillées (19.1 à 19.10) | La pile Daniell (html-1) (swf-1) (html-2) (swf-2) (animations) Une pile galvanique (swf) (mp4) (html) (animations) La pile Daniell a été inventée par le chimiste britannique John Daniell en 1836 au moment où le développement du télégraphe faisait apparaître un besoin urgent de sources de courant sûres et constantes. La pile électrique Daniell est constituée d'une anode (lame de zinc plongée dans une solution contenant du sulfate de zinc) et d'une cathode (lame de cuivre plongée dans une solution contenant du sulfate de cuivre). Les deux solutions sont reliées par un pont salin (solution de chlorure de potassium (KCl)) qui sert à équilibrer les charges. Electrochimie-Nernst (vidéo) La pile au "citron" (film) Comment recharge-t-on une pile ? (film) C'est pas sorcier : "Les piles" |
Electrolyse (OC)
L'électrolyse est une méthode qui permet de réaliser des réactions chimiques grâce à une activation électrique. C'est le processus de conversion de l'énergie électrique en énergie chimique. Elle permet par ailleurs, dans l'industrie chimique, la séparation d'éléments ou la synthèse de composés chimiques. La première électrolyse par courant continu (électrolyse de l'eau) a été réalisée le 2 mai 1800 par deux chimistes britanniques, William Nicholson (1753-1815) etSir Anthony Carlisle (1768-1842), quelques jours après l'invention de la première pile électrique (publication soumise le 20 mars 1800 dans une lettre en français au président de la Royal Society, Joseph Banks) par Alessandro Volta. Par ailleurs, onze ans auparavant J. R. Deiman et A. Paets van Troostwijk avaient déjà réalisé une électrolyse de l'eau au moyen d'une machine électrostatique et d'une bouteille de Leyde sans réussir à interpréter la réaction observée.
| Image | Le cours | Les compléments |
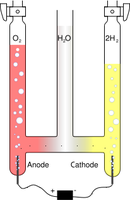 | Théorie (prof.) Exercices Ex. supplémentaires (11.1 à 11.11) Solutions Solutions détaillées (11.1 à 11.11) | Voltamètre d'Hoffmann (Wikipédia) Electrolyse de l'eau (video) |
pH des acides forts et bases fortes
- inférieur à 7 est acide ;
- supérieur à 7 est basique ;
- égal à 7 est neutre.
| Image | Le cours | Les compléments |
 | Théorie Exercices Exercices supplémentaires (15.1 à 16.17) Solutions Solutions détaillées (15.1 à 16.17) | Le chaulage (lecture) Dosage acide-base (html) (swf) (animation) |
Equilibre acide-base
Lorsqu'un acide faible AH est mis en présence d'eau, la réaction suivante a lieu : AH + H2O ↔ A- + H3O+
La réaction n'est pas totale mais équilibrée, c'est-à-dire que pour avoir plus de substance du côté droit de la réaction, il faut ajouter plus de produit AH du côté gauche, dès lors il reste toujours de l'acide AH en solution. On classe les acides faibles en fonction de leur constante d'acidité, c'est-à-dire en fonction de leur capacité à plus ou moins se dissocier en présence d'eau. On estime qu'un acide est faible lorsque son pKa est supérieur à 0. Un acide est d'autant plus faible que son pKa est élevé. Sa base conjuguée est donc d'autant plus forte et moins stable que ce même pKa est élevé.
| Image | Le cours | Les compléments |
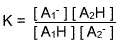 | Théorie Exercices Ex. supplémentaires (17.1 à 18.9) Solutions Solutions détaillées (17.1 à 18.9) | Acide fort, acide faible (image) Le pH sanguin (document) Acide faible ou acide fort (swf) (html) (animation) Base faible ou base forte (animation) Les solutions tampons (swf) (html) (animation) Le diagramme de prédominance (film) La théorie de Bronsted-Lowry (film) |
Les courbes pH-métriques
La titrimétrie ou titrage est une technique de dosage utilisée en chimie analytique afin de déterminer la concentration d'une espèce chimique en solution (ou titre d'une solution). La méthode de titrage la plus utilisée est la volumétrie ou titrage volumétrique. Elle consiste à utiliser une solution de concentration connue (appelée titrant) afin de neutraliser une espèce contenue dans la solution inconnue (espèce titrée). Les titrages volumétriques les plus répandus sont les titrages acide-base : l'opérateur fait couler goutte à goutte un acide dans un volume déterminé de base. Ainsi les réactifs réagissent mol à mol. Le point de neutralisation est connu entre autres, grâce à un indicateur coloré ajouté dans la solution inconnue (cet indicateur change de couleur au moment de la neutralisation) ou grâce à une variation du potentiel ou du pH (mesuré au moyen d'une électrode trempant dans la solution inconnue).
| Image | Le cours | Les compléments |
 | Théorie Exercices Ex. supplémentaires (18.1 à 18.9) Solutions Solutions détaillées (18.1 à 18.9) | Courbes de titrage (visualisation et calcul du pH) |
Equilibre de solubilité
Le produit de solubilité est la constante d'équilibre correspondant à la dissolution d'un solide dans un solvant. La valeur du produit de solubilité dépend de la température. En général, elle croît avec la température. Le produit de solubilité est un nombre sans dimension, il n'a donc pas d'unité. Non, le produit de solubilité n'est pas un produit de concentrations, mais un produit de valeurs numériques (en mol/L) de concentrations. Il s'agit d'une constante thermodynamique intervenant dans la Loi d'action de masse.
| Image | Le cours | Les compléments |
 | Théorie Exercices Ex. supplémentaires (14.1 à 14.10) Solutions Solutions détaillées (14.1 à 14.10) |
Les complexes (OC)
En chimie, plus particulièrement en chimie inorganique, un complexe est un édifice polyatomique constitué d'un ou de plusieurs cations (le plus souvent métallique) entouré de plusieurs ligands qui sont des molécules ou des ions qui délocalisent une partie de leur densité électronique sur le cation, formant ainsi des liaisons chimiques avec celui-ci. Les subdivisions de la chimie décrivant la formation, la structure et la réactivité de ces complexes sont la chimie organométallique (si le complexe comporte des liaisons métal-carbone) et la chimie de coordination (dans le cas contraire).
| Image | Le cours | Les compléments |
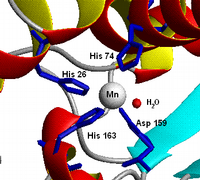 | Théorie Exercices Solutions | Structure électronique (document) Modèles (1) (figure) Éléments de cristallographie (animation .mov) |
Bibliographie
| Chimie fondamentale(Raymond Chang, Luc Papillon) | Chimie de base et avancée | Exercices de chimie, brochure "officielle" | |
 |  |  |  |